- Γράφει ο Κοσμάς Ζακυνθινός
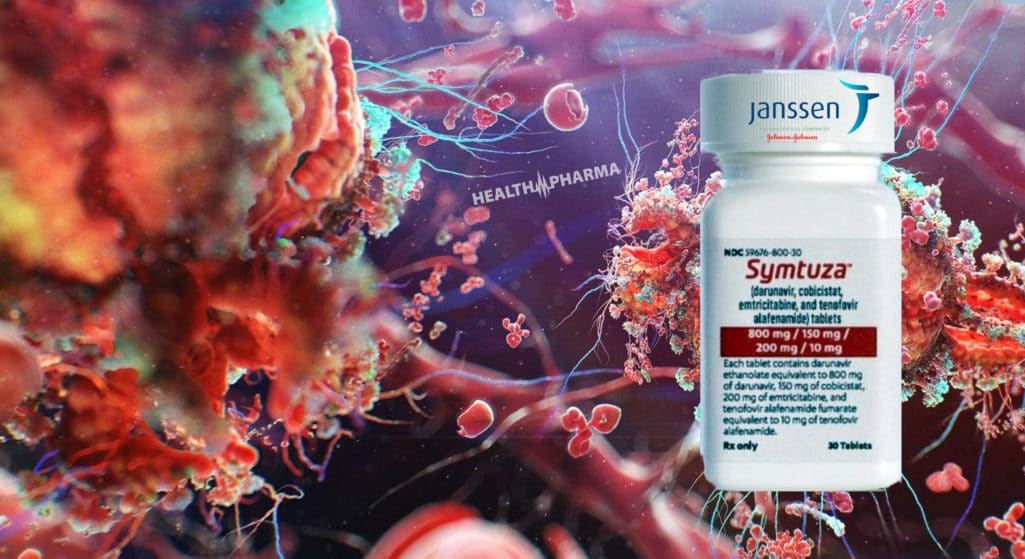
«Πράσινο φως» από την Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων (FDA) λαμβάνει το Symtuza της Janssen (μονάδα της Johnson & Johnson) για τη θεραπεία ενήλικων ασθενών με HIV που είτε δεν έχουν λάβει θεραπεία έως τώρα, είτε έχουν ιολογικώς κατασταλεί με αντιρετροϊκό σχήμα. Το Symtuza φέρει σχετική προειδοποίηση «μαύρου πλαισίου» για παρόξυνση χρόνιας ηπατίτιδας Β, μετά τη θεραπεία.
Το σκεύασμα αποτελεί τον πρώτο και μοναδικό συνδυασμό δαρουναβίρης σε μορφή χαπιού (STR) το οποίο, σύμφωνα με την Johnson & Johnson, έχει βελτιωμένη ανεκτικότητα για τη θεραπεία του ιού της ανθρώπινης ανοσοανεπάρκειας τύπου 1 (HIV-1), συνδυάζοντας την ευκολία μιας απλής δόσης.
«Πολλοί άνθρωποι που ζουν με τον ιό HIV και ακολουθούν τη φαρμακευτική αγωγή τους, ενδέχεται να αναπτύξουν αντοχή στα φάρμακα, με αποτέλεσμα να μην υπάρχει θεραπευτική ανταπόκριση» όπως επισημαίνει ο Joseph Eron, MD, καθηγητής ιατρική και διευθυντής του University of North Carolina Center for AIDS Research.
Σύμφωνα με τους αναλυτές, μεγάλη πρόκληση για το Symtuza αποτελεί η «είσοδος» του σε μια αγορά σχετικά «δομημένη», όπου επικρατούν φάρμακα όπως το Juluca, του πρώτου θεραπευτικού σχήματος που περιέχει μόνο δύο φάρμακα -το οποίο η J&J ανέπτυξε με την GlaxoSmithKline-, αλλά κυρίως να αντιμετωπίσει το Biktarvy της Gilead.
Το[bictegravir 50mg/εμτρισιταβίνη (emtricitabine) 200 mg/tenofovir alafenamide 25 mg – BIC/FTC/TAF] εγκρίθηκε στις αρχές του τρέχοντος έτους από τον FDA, ενώ στα μέσα του έτους έλαβε άδεια κυκλοφορίας και από την Ευρωπαϊκή Επιτροπή ως ολοκληρωμένο θεραπευτικό σχήμα ενός δισκίου που λαμβάνεται άπαξ ημερησίως (STR) για τη θεραπεία της λοίμωξης από τον ιό HIV-1.
 Στην Ευρώπη, το σχήμα BIC/FTC/TAF ενδείκνυται ως πλήρες σχήμα για τη θεραπεία της λοίμωξης από τον ιό HIV-1 σε ενήλικες χωρίς υπάρχουσα ή προηγούμενη ένδειξη αντοχής του ιού στις δραστικές ουσίες ιντεγκράσης, emtricitabine ή tenofovir. Δεν απαιτείται προσαρμογή της δόσης BIC/FTC/TAF σε ασθενείς με εκτιμώμενη κάθαρση κρεατινίνης (CrCL) μεγαλύτερης ή ίσης των 30 mL ανά λεπτό. Το σχήμα BIC/FTC/TAF προσφέρει πρακτική δοσολογία, δεν απαιτεί την εξέταση HLA-B 5701, και δεν έχει διατροφικούς περιορισμούς, ούτε περιορισμούς ως προς το ιϊκό φορτίο ή τον αριθμό κυττάρων CD4.
Στην Ευρώπη, το σχήμα BIC/FTC/TAF ενδείκνυται ως πλήρες σχήμα για τη θεραπεία της λοίμωξης από τον ιό HIV-1 σε ενήλικες χωρίς υπάρχουσα ή προηγούμενη ένδειξη αντοχής του ιού στις δραστικές ουσίες ιντεγκράσης, emtricitabine ή tenofovir. Δεν απαιτείται προσαρμογή της δόσης BIC/FTC/TAF σε ασθενείς με εκτιμώμενη κάθαρση κρεατινίνης (CrCL) μεγαλύτερης ή ίσης των 30 mL ανά λεπτό. Το σχήμα BIC/FTC/TAF προσφέρει πρακτική δοσολογία, δεν απαιτεί την εξέταση HLA-B 5701, και δεν έχει διατροφικούς περιορισμούς, ούτε περιορισμούς ως προς το ιϊκό φορτίο ή τον αριθμό κυττάρων CD4.
Η έγκριση του FDA για το Symtuza βασίστηκε στα αποτελέσματα δύο μελετών Φάσης ΙΙΙ και διάρκειας 48 εβδομάδων. Η μελέτη AMBER εξέτασε την ασφάλεια και την αποτελεσματικότητα του Symtuza σε ενήλικες, ενώ η μελέτη EMERALD αξιολόγησε τους ιολογικώς κατασταλμένους ενήλικες. Και οι δύο μελέτες διαπίστωσαν ότι το φάρμακο ήταν αποτελεσματικό και καλά ανεκτό, με ποσοστό έως και 95% των ασθενών να επιτυγχάνουν ή να διατηρούν ιολογική καταστολή. Το φάρμακο έχει ήδη εγκριθεί στην Ευρώπη.